Batteries AGM » Puissantes batteries au plomb avec technologie AGM intelligente
Publié le : 10.10.2023 | Durée de lecture : 7 minutes
Bien avant l'essor de la mobilité électrique, chaque automobiliste avait déjà une batterie de démarrage dans son véhicule. Il s'agissait d'une batterie acide au plomb qui était chargée par l'alternateur pendant la conduite.
Les batteries plomb-acide étaient peu coûteuses et pouvaient, si nécessaire, fournir le courant requis au démarreur électrique. Cependant, le fait qu'elles soient aussi lourdes en plomb ne jouait pas un rôle aussi important pour les batteries de véhicules. En principe, les batteries de démarrage présentaient un rapport qualité-prix raisonnable et fonctionnaient si bien qu'aucune évolution notable n'a eu lieu pendant des années.
Le seul véritable problème des piles ouvertes était l'évaporation de l'eau. Pour ne pas raccourcir leur durée de vie, les batteries devaient être remplies de temps en temps avec un peu d'eau distillée. Cela n'a changé que lorsque les premières batteries à technologie AGM ont été montées dans les nouveaux véhicules.
Afin d'obtenir des batteries au plomb sans entretien et donc plus faciles à utiliser, deux voies différentes ont été suivies. D'une part, l'acide sulfurique liquide dilué a été épaissi avec du dioxyde de silicium et introduit dans l'accumulateur sous forme de gel.
Ces accumulateurs plomb-gel pouvaient alors être scellés hermétiquement et pouvaient donc être utilisés quelle que soit leur position. Il faut toutefois veiller, lors de la charge, à ce que la tension de charge ne soit pas trop élevée et que l'accumulateur ne commence pas à dégazer. En cas d'urgence, il existe donc pour chaque cellule une soupape de sécurité qui se déclenche en cas de pression interne trop élevée.
Une autre solution était la technologie du non-tissé, dans laquelle l'acide sulfurique dilué est toujours liquide, mais est absorbé par un non-tissé spécial. C'est de cette technique que dérive l'appellation de batterie AGM (Absorbent Glass Mat).
Une batterie de type "Absorbent Glass Mat" est en principe un accumulateur plomb-acide fermé, dans lequel le non-tissé situé entre les plaques de plomb retient l'électrolyte, c'est-à-dire l'acide sulfurique dilué, comme une éponge.
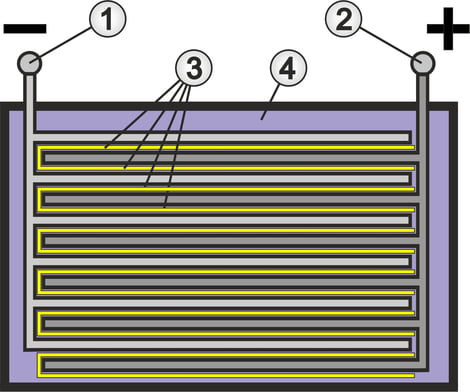
Structure de base des batteries au plomb
Dans un conteneur résistant aux acides se trouvent deux électrodes en plomb dont l'intérieur est constitué d'une grille (voir illustration de la section précédente).
L'électrode négative (1) est recouverte de plomb poreux (Pb), également appelé éponge de plomb. L'électrode positive (2) est recouverte de dioxyde de plomb poreux (PbO2). Ces revêtements sont également appelés masse active, car ils participent activement à la réaction chimique. La structure poreuse est nécessaire pour obtenir la plus grande surface possible pour la réaction chimique lors de la charge et de la décharge.
Afin d'augmenter l'efficacité en termes de capacité et d'émission de courant, les électrodes sont conçues comme des groupes imbriqués. Les plaques positives et négatives sont reliées électriquement entre elles.
Entre les plaques imbriquées de chaque groupe se trouve un séparateur en PVC ondulé (3) qui empêche le contact direct (court-circuit) entre les plaques. Dans le cas d'une batterie AGM, c'est le matelas de fibres de verre qui joue le rôle de séparateur.
L'électrolyte (4) est un acide sulfurique (H2SO4) dilué avec de l'eau, ce qui permet un échange de charges entre les plaques. Le rapport entre l'eau et l'acide sulfurique est alors choisi de manière à obtenir une dissociation idéale, c'est-à-dire la décomposition de composés chimiques en molécules, atomes ou ions. On obtient ainsi une conductivité ionique optimale dans l'électrolyte. L'acide sulfurique pur ou l'eau seule ne fonctionneraient pas dans ce cas.
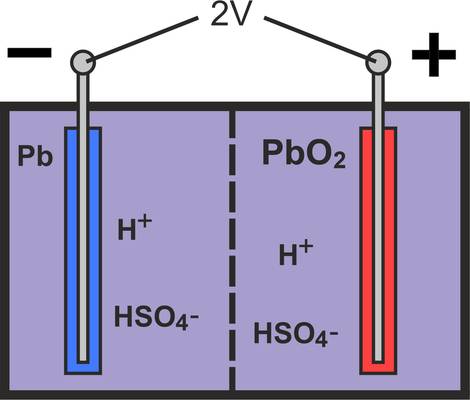
Lorsque le réservoir contenant les électrodes mentionnées ci-dessus est rempli d'acide sulfurique dilué (1,28 kg/l), il y a un excès d'électrons sur l'électrode négative de la batterie et un manque d'électrons sur l'électrode positive.
La différence de potentiel entre les deux électrodes est d'environ 2 V et peut varier entre 1,75 et 2,4 V selon l'état de charge. La raison en est évidente si l'on examine de plus près les processus chimiques de charge et de décharge. Pour plus de clarté, nous n'avons représenté qu'une seule électrode compacte dans les dessins de cette section.
Étant donné qu'une batterie dont la tension nominale n'est que de 2 V n'est pas adaptée au fonctionnement d'un véhicule, 6 cellules sont montées en série dans une batterie de voiture. La batterie atteint ainsi une tension aux bornes de 12 V (6 x 2 V). Pour le fonctionnement dans un camion, deux batteries de 12 V sont connectées en série afin que le véhicule puisse être alimenté en 24 V. Ainsi, les consommateurs électriques peuvent être alimentés sans problème, même si le véhicule est immobilisé pendant une longue période, sans que des problèmes de démarrage apparaissent par la suite.
Processus de décharge
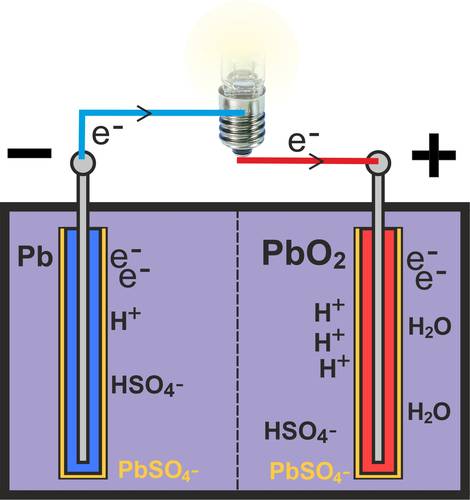
Lors de la décharge d'une cellule d'accumulateur au plomb entièrement chargée, la cellule est déchargée via le circuit électrique externe (voir lampe sur l'image). Des électrons (e-) circulent alors via le circuit électrique externe de l'électrode négative (pôle négatif de l'accumulateur) à l'électrode positive (pôle positif).
Comme l'acide sulfurique (H2SO4) est à l'état dissocié, l'hydrogénosulfate (HSO4-) s'oxyde à l'électrode négative (Pb) en sulfate de plomb poreux (PbSO4), ce qui libère de l'hydrogène (H+). Simultanément, des électrons libres (e-) se forment à l'électrode négative et circulent vers le pôle positif via le circuit électrique externe.
L'équation chimique se présente alors comme suit :
Pb + HSO4- → PbSO4 + H+ + 2e-
Une réduction a lieu au pôle positif de la batterie au plomb. En absorbant des électrons (e-), le dioxyde de plomb (PbO2) de l'électrode est réduit avec l'hydrogénosulfate (HSO4-) et l'hydrogène (H+) en sulfate de plomb (PbSO4) et en eau (H2O).
Dans ce cas, l'équation se présente comme suit :
PbO2 + HSO4- + 3H+ + 2e- → PbSO4 + 2H2O
Si l'on considère la réaction globale, le plomb, le dioxyde de plomb et l'acide sulfurique réagissent pour former du sulfate de plomb et de l'eau.
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
Par conséquent, la concentration d'acide dans l'électrolyte diminue lors de la décharge.
Processus de charge
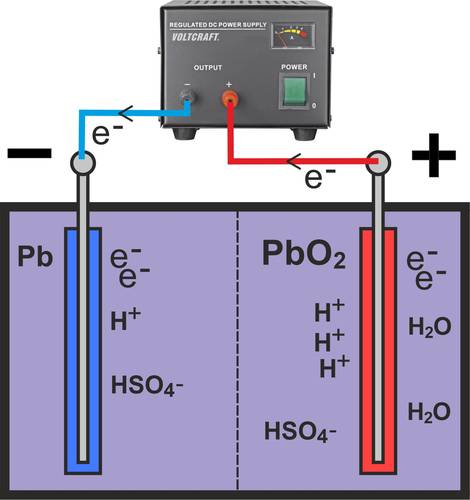
Lorsque la tension de charge est appliquée, des électrons sont ajoutés à l'électrode négative et retirés de l'électrode positive. Les réactions chimiques qui ont eu lieu lors de la décharge se déroulent alors à l'envers.
Le sulfate de plomb (PbS04) présent est réduit en plomb (Pb) et en hydrogénosulfate (HSO4-) en absorbant de l'hydrogène et des électrons. L'équation chimique se présente alors comme suit :
PbSO4 + H+ + 2e- → Pb + HSO4-
Une oxydation se produit alors au pôle positif. En libérant des électrons, le sulfate de plomb (PbSO4) et l'eau (H2O) redeviennent du dioxyde de plomb (PbO2), du sulfate d'hydrogène (HSO4-) et de l'hydrogène (H+).
Dans ce cas, l'équation est maintenant inversée :
PbSO4 + 2H2O → PbO2 + HSO4- + 3H+ + 2e-
Par conséquent, la proportion d'acide dans l'électrolyte augmente lors du processus de charge, ce qui est également visible dans l'équation globale :
2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4
C'est aussi la raison pour laquelle il est possible de vérifier l'état de charge actuel de la batterie au plomb à l'aide d'un élévateur d'acide de batterie pour les batteries au plomb ouvertes.
Le principal avantage des batteries AGM est le nombre élevé de cycles de charge. Les batteries offrent ainsi une durée de vie nettement plus longue que les batteries humides conventionnelles. Dans l'utilisation de véhicules, la faible résistance interne permet des courants très élevés pour le processus de démarrage, qui sont également disponibles en hiver grâce à la grande stabilité au froid.
C'est pourquoi la technologie AGM est également utilisée dans les véhicules dotés de la fonction start-stop. De plus, les batteries ne nécessitent pratiquement pas d'entretien et peuvent être déchargées très profondément si nécessaire, sans subir de dommages. Grâce à la technologie Glass Mat, l'électrolyte ne peut pas fuir, même si le boîtier fait l'objet de dommages mécaniques.
Contrairement aux batteries plomb-acide traditionnelles, les batteries AGM ont, de par leur construction, une résistance interne plus faible. Elles sont donc en mesure de délivrer des courants très élevés. Comme il n'y a ni couche d'acide ni perte d'eau, les batteries ont une très longue durée de vie et présentent une résistance aux cycles nettement plus élevée.
C'est pourquoi les batteries AGM sont idéales comme batteries de démarrage pour les véhicules équipés de la technologie start-stop ou de la récupération de l'énergie de freinage.
Comme les batteries AGM sont complètement fermées, elles peuvent également être utilisées dans les camping-cars. Mais les batteries AGM sont également utilisées dans les systèmes d'alarme, les installations solaires, les onduleurs ou même dans les véhicules électriques (chariots élévateurs ou scooters). Grâce à leur faible autodécharge, elles résistent sans problème aux longues périodes d'immobilisation.
La défaillance prématurée des batteries au plomb peut avoir de multiples causes. Nous avons brièvement résumé les principales causes de défaillance :
Perte d'eau
L'une des principales raisons de la courte durée de vie ou de la défaillance prématurée des accumulateurs au plomb-acide était la perte d'eau due à l'évaporation et donc au fait que les plaques de plomb étaient à sec. Dans le cas des batteries au gel ou AGM, l'évaporation est empêchée ou minimisée par le boîtier fermé.
Stratification d'acide
Mais la stratification de l'acide peut également devenir un problème pour les batteries plomb-acide. Pendant le processus de décharge, la densité de l'acide dans l'électrolyte diminue, ce qui fait que la proportion d'acide dans l'espace de boue sous les plaques est nettement plus élevée que dans la partie supérieure. Dans le cas d'une batterie AGM, le non-tissé réduit la stratification de l'acide.
Sulfatation
Un autre critère de vieillissement est la sulfatation, au cours de laquelle la couche de sulfate de plomb, normalement poreuse, prend une structure cristalline. De ce fait, elle ne participe plus activement au processus de charge et de décharge. Cela peut se produire en raison de la couche acide déjà mentionnée ou lorsque les accumulateurs sont restés longtemps dans un état de décharge partielle ou même de décharge complète.
Érosion
Lors de l'érosion, le matériau actif se détache du limiteur de surtension (grille). Cela se produit en raison des contraintes mécaniques lors des processus de charge et de décharge, du gazage ou encore des intensités élevées. Les conséquences sont des pertes de capacité importantes, une durée de vie réduite, une résistance interne plus élevée et des courts-circuits à l'intérieur des cellules.
Corrosion
La corrosion entre la grille et la masse active sur l'électrode positive est tout aussi problématique. Outre stratification de l'acide et les températures élevées, le potentiel de l'électrode et la qualité du matériau sont également responsables d'une corrosion de la grille. Les fabricants ajoutent parfois de l'antimoine, du calcium ou de l'argent afin d'améliorer les propriétés mécaniques et électriques.
Notre conseil pratique : éviter la sulfatation
Dans la mesure du possible, les batteries au plomb devraient toujours être maintenues en état de pleine charge. Même pendant le stockage. Pour éviter la sulfatation, les batteries devraient être rechargées de temps en temps à l'aide d'un chargeur adéquat si elles ne sont utilisées que sporadiquement dans des véhicules.
Dans le cas contraire, la sulfatation peut entraîner une défaillance de la batterie. C'est pourquoi certaines entreprises proposent des rafraîchisseurs ou des pulseurs qui évitent la structure cristalline ou de briser à nouveau les structures existantes.
Pourquoi les batteries AGM ne sont-elles pas en général placées dans le compartiment moteur ?
Comme les batteries AGM ne supportent pas les températures élevées, elles ne sont pas installées à proximité immédiate du moteur à combustion.
Les batteries AGM peuvent-elles être chargées avec n'importe quel chargeur conventionnel ?
Les chargeurs à transformateur non régulés ne sont pas adaptés.Dans l'idéal, le chargeur devrait fonctionner selon la courbe caractéristique IUoU. Dans ce cas, on travaille d'abord avec un courant de charge continu (I) jusqu'à ce que la tension de charge maximale soit atteinte. La tension de charge reste ensuite continuellement au même niveau, ce qui fait que le courant de charge diminue avec le temps. Lorsque le courant de charge minimal n'est plus atteint, le système passe automatiquement à la charge de maintien.
Quels travaux d'entretien faut-il effectuer sur les batteries AGM ?
Les batteries sans entretien doivent simplement être chargées régulièrement. Si cela ne se fait pas automatiquement en fonctionnement normal, un chargeur doit être branché à intervalles réguliers pour éviter une décharge trop profonde. Il convient alors de procéder à un contrôle visuel des pôles de connexion et d'éliminer les éventuelles salissures. Aucun autre entretien n'est nécessaire.
Que signifie la capacité sur une batterie ?
La capacité d'une batterie indique la quantité d'électricité qu'elle peut fournir sur une période donnée. La capacité de la batterie est donc exprimée en ampères-heures (Ah). Une batterie d'une capacité de 18 Ah, par exemple, peut fournir un courant de 1,8 A pendant 10 heures. Si les courants sont supérieurs à 1/10 de la valeur de la capacité, la capacité de la batterie indiquée par le fabricant et effectivement utilisable est réduite.
Que signifie « batterie à cycle profond » ?
Les batteries à cycle profond (Deep Cycle) peuvent être déchargées très profondément sans perdre de puissance ni être endommagées. En particulier lorsque les véhicules équipés du système start-stop ne roulent que sur de courtes distances en hiver, les batteries de démarrage équipées de la technologie traditionnelle (batteries plomb-acide) peuvent rapidement subir une décharge trop profonde.